试验|pH3.2安卫适®干粉消毒剂抑制非洲猪瘟病毒效果评估
试验目的
病毒是最小和最复杂的传染源之一,导致猪的许多健康问题,影响动物的福利和养殖效益。今天,人们关注的焦点集中在非洲猪瘟,这是一种最具破坏性的疾病,尚无有效的治疗方法得到验证。在这种情况下,预防是抵御疾病的第一道防线,控制疫情的唯一方法是采取强有力的生物安全措施(HC de Carvalho Ferreira 等人,2012 年) 。
安卫适®是一种干粉消毒剂,通过干燥和酸化双重功效,给众多病原体提供了无法生存的体外环境。该试验目的是评估安卫适®在无菌水和不同的生物材料(血液、唾液、尿液和粪便)中抑制非洲猪瘟病毒的功效,以更接近猪场真实的饲养环境。
材料与方法
病毒
用于测试的病毒株是VNUA/HY.ASF1/Vietnam/2019,它是从越南兴安省受感染母猪脾脏病变的肺泡巨噬细胞中分离出来的(Van Phan Le 等, 2019)。提取病毒并培养至滴度为108 HAD50/ml。
滴定方法
病毒滴定程序已根据Reed et al.(1938)方法进行。校准曲线已使用实时荧光定量PCR获得的病毒样本的Ct值(循环阈值)实施。基于校准曲线,与对照组相比,通过跟踪病毒滴度随时间的演变来测量安卫适®的功效。使用安卫适®后病毒滴度的降低已表示为log10 HAD50值。
DNA提取和实时荧光定量PCR
使用(Qiagen美国)QIAamp DNA试剂盒提取病毒基因组DNA。随后,使用韩国Median Diagnostics公司的实时荧光定量PCR试剂盒对病毒遗传物质进行实时荧光定量PCR检测。为确保实时PCR的正常运行,在PCR测试之前使用法国Indicia公司的通用中和剂中和安卫适®的酸度。
测试条件
测试在无菌水、血液、唾液、尿液和粪便中进行。这些生物样本是从感染ASF病毒的猪身上采集的。测试的第一个条件是阳性对照:未使用安卫适®的无菌水和生物材料。样本中的初始病毒浓度符合科学参考文献(H.C. de Carvalho Ferreira et al, 2012)。
-
无菌水 : 105 HAD50
-
血液 : 107.22 HAD50
-
唾液 : 104.10 HAD50
-
尿液 : 104.55 HAD50
-
粪便 : 102.88 HAD50
试验就粪便,人工设计了一个高病毒载量的试验组,以测试安卫适®降低粪便中病毒载量的全部能力。这种情况被称为“粪便峰值”。
-
粪便峰值: 105 HAD50
然后我们验证了中和肉汤的效率以及对实时PCR的干扰。最后,将安卫适®以10%的浓度与不同样本混合,并在3个不同的培养时间(7分钟、20分钟和1小时)中接触。每种条件都进行了三次重复测试,所显示的结果是从实时PCR获得的3个值的平均值。
试验结果
下图显示了安卫适®与不同生物样品接触7分钟、20分钟和1小时后病毒滴度的变化,与对照组(无安卫适®)相比。
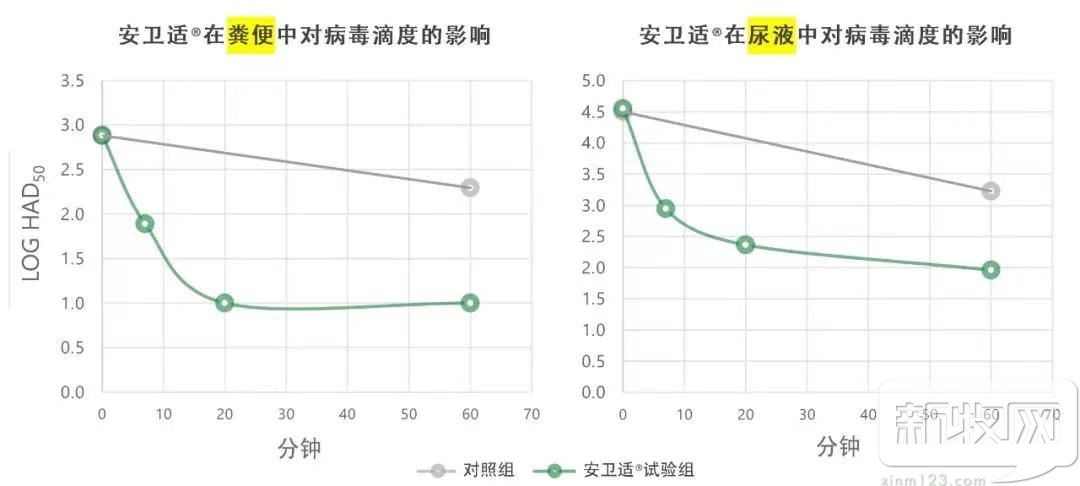
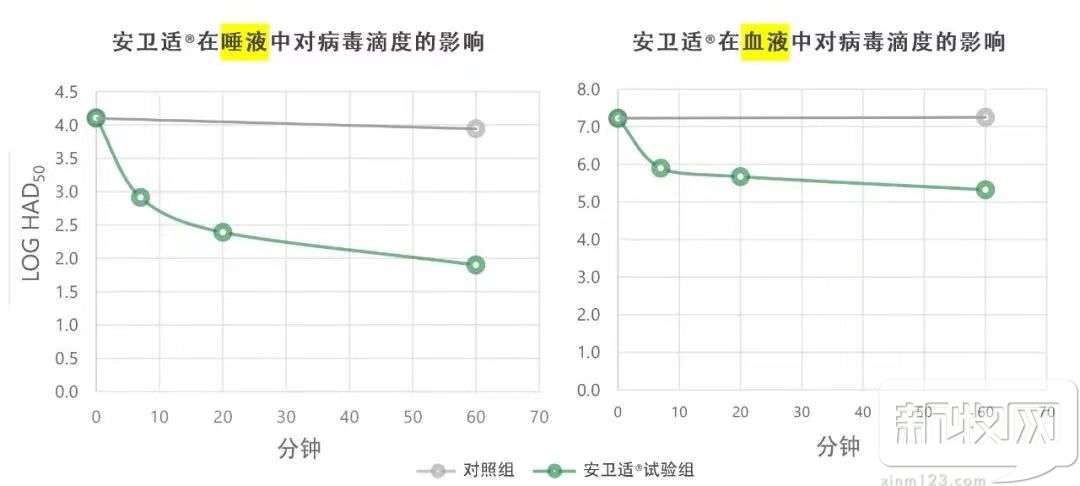
在最初的10-20分钟内,所有样本中的病毒滴度迅速降低,从20分钟到1小时的培养时间降低得更慢,表明安卫适®对非洲猪瘟病毒的快速作用。
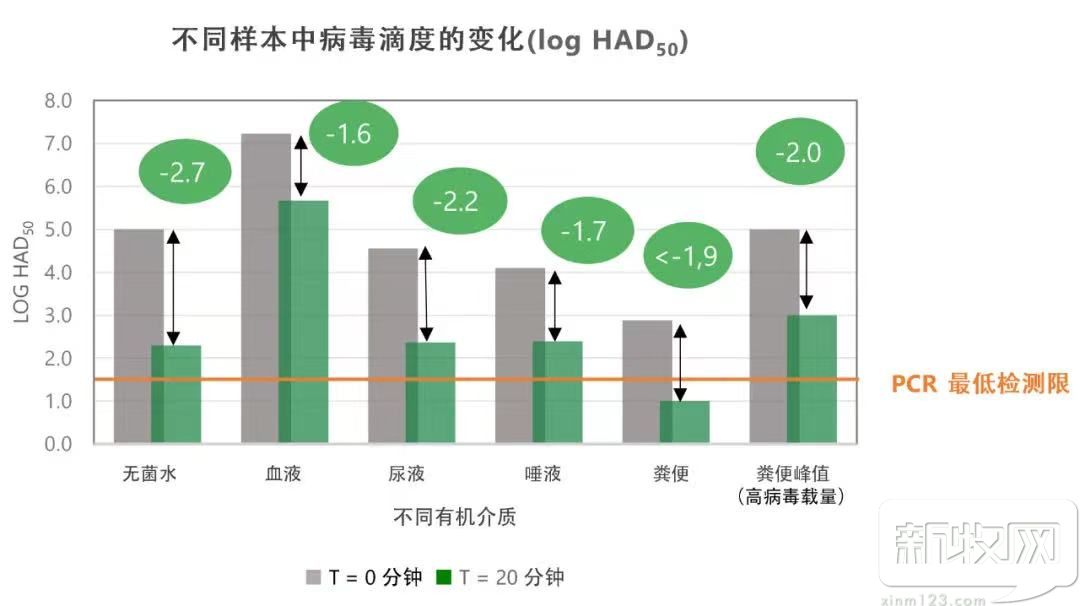
我们也可以通过下图,在各组样本,(包括粪便峰值组)和无菌水中观察到病毒滴度的变化:
试验结论
不同生物样本中的病毒水平与文献一致(H.C. de Carvalho Ferreira et al, 2012)。安卫适®与病毒在无菌水或生物接触20分钟后,结果显示病毒滴度显著降低,在血液中的1.6 log HAD50和尿液中的2.2 log HAD50之间变化。在养殖环境中存在量******的是尿液和粪便,安卫适®能够将病毒滴度降低2和2.2 log HAD50。低于1.5 log HAD50的病毒水平表明病毒的感染能力丧失。这些结果证实,安卫适®的干粉对生物材料(血液、唾液、尿液和粪便)中的ASF病毒具有消毒能力。
原文作者:越南国立农业大学兽医生物技术重点实验室副主任黎文范(Le Van Phan)博士
参考文献列
Reed, L. J., & Muench, H. (1938). A simple method of estimating fifty per cent endpoints. American journal of epidemiology, 27(3), 493-497.
Van Phan Le, D. G. J., Yoon, S.-W., Kwon, H.-M., Trinh, T. B. N., Nguyen, T. L., Bui, T. T. N., . . . Van Tuyen, N. (2019). Outbreak of African swine fever, Vietnam, 2019. Emerging infectious diseases, 25(7), 1433.
H.C. de Carvalho Ferreira, J.A. Backer, E. Weesendorp, D. Klinkenberg3, J.A. Stegeman, W.L.A Loeffen, (2012). Transmission rate of African swine fever virus under experimental conditions. Veterinary Microbiology, 165(3-4) : 296-304.
H.C. de Carvalho Ferreira, E. Weesendorp, S. Quak, J.A. Stegeman, W.L.A. Loeffen. Inactivation of African swine fever virus in tissues, faeces and urine.

越南国立农业大学兽医生物技术重点实验室团队
相关热词搜索:
上一篇:肠道菌群对动物免疫的影响
下一篇:如何做好对拉猪车司机的生物安全管理?细节与执行很关键








 推荐新闻
推荐新闻












