作为诊断工具的 PCR 检测
聚合酶链反应(PCR)是当今猪生产医学中最常用的诊断工具之一。它不仅用于诊断,而且还用于通过监测和疾病监测改善生物安全的手段。因此,在解释结果时,了解此类技术的优缺点至关重要。同样重要的是要记住,虽然相同的技术被用于不同的病原体,但这些结果的解释方式应该有所不同。
检测信息
PCR分析是为检测细菌或病毒的遗传物质(DNA或RNA)而设计的。该过程首先从样品中提取DNA或RNA,然后通过热循环进行扩增。如果目标材料是RNA,第一步是将RNA转化为DNA(技术上称为cDNA)。热循环旨在创建一个三步过程,即1)变性、2)退火和3)延伸,从而导致样品中DNA的复制。因此,对于每个循环(1 Ct),假设100%的效率,将存在两倍的DNA。然后,目标是继续扩增过程,直到检测到足够的DNA供样本检测阳性或最多30-40个循环,具体取决于所使用的特定分析的设计。
PCR的原理图
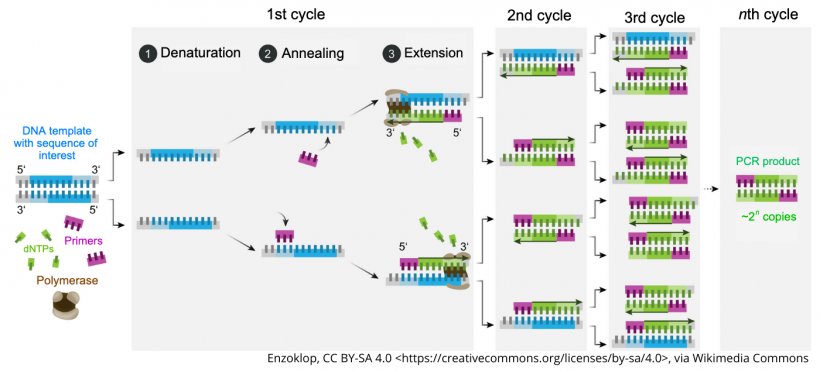
提取过程是PCR分析的一个关键步骤,因为它影响被测样本中遗传物质的数量和质量。对于正在测试的样本类型(血清、口腔液、组织等),使用适当的提取过程至关重要。扩增过程的第2步(退火过程)需要使用引物,这些引物是DNA序列的短片段,专门设计用于连接和帮助复制目标病原体的特定基因序列。对于在基因上不断进化的病原体(如PRRS病毒),必须定期更新这些引物,以确保仍能检测到新菌株。
确定分析周期截止点(通常在30-40左右)是因为认识到,如果扩增过程继续进行,最终分析将仅仅由于将开始发生的自发退火和延伸而转为阳性。这表明,弱阳性结果,接近临界值的高Ct值,在解释结果时需要特别考虑 ,尤其是在疫情结束时。
猪医学中有两种不同的PCR检测方法。传统的基于凝胶的PCR和更现代的实时PCR。这两种检测方法的工作原理相同,都依赖于DNA或RNA的扩增。不同之处在于,基于凝胶的分析在测定结束时仅“读取”一次,而使用实时PCR,则在每个循环后“读取”测定结果。实时PCR的优点是可以得到定量/半定量结果。
用于测试的样本池
PCR 检测由于其对样本中遗传物质的扩增过程而具有很强的检测样本中少量遗传物质的能力(分析灵敏度)。这提供了通过单一测定(样本池)评估多个样品的机会。重要的是要记住,根据定义,合并样本会稀释评估的样本。当特定病原体的预期浓度很高时(尤其是在疾病的早期爆发中),这应该不是问题。 当阳性样本中的病原体浓度较低时,例如在疾病爆发结束时或在预计已经被稀释的样本类型上(口腔液体),合并样本可能是一个问题。
PCR 检测的一些用途:
- 检测目标病原体的DNA/RNA的存在-最常用
- 通过针对已知在不同血清型之间变化的特定基因(DNA/RNA)对病原体进行血清分型(例如胸膜肺炎放线杆菌的荚膜生物合成基因)
- 检测毒力基因的存在(例如,大肠杆菌基因分型)
重要的是要记住,PCR检测仅检测基于引物的目标遗传物质的存在,而不表明生物体是否具有传染性。在检测基因时,该检测仅检测基因的存在,而不检测生物体是否表达检测到的毒力因子。

近年来,实验室开发了多重PCR,以同时检测多种病原体或同一病原体的多个菌株或基因。多重PCR是同时运行多个PCR。它们的成本高于单个PCR,但比单独运行PCR的成本要低得多,因为实验室在设备使用、实验室人员和试剂使用方面节省了大量成本。实验室将使用不同的标记来帮助确定哪些阳性结果属于哪些引物。通常,这些多重PCR是有意义的,例如测试大肠杆菌基因分型,其中可以在同一细菌分离物上同时评估大约14个基因。另一个例子是同时测试1型和2型PRRS。另一种常见的检测方案是同时检测猪流行性腹泻和猪Delta冠状病毒。需要注意的是,这些分析的使用并不总是容易的,因为实验室需要确保不同PCR检测之间没有干扰。也就是说,循环温度和使用的不同引物不会相互抑制或交叉反应。这些多重PCR中的每一种都必须在使用前进行验证,并且必须对检测进行显著优化。
解释结果的注意事项:
PCR检测的挑战之一是,每个实验室的样本检测方案往往不同,其中可能包括DNA/RNA提取过程的差异、循环方案的差异以及所用引物的差异。这使得对从不同实验室获得的结果进行密切比较具有挑战性。
阴性结果
- 病原体真正呈阴性的样本/猪群
- 确保针对目标病原体提交了适当的样本。需要考虑的一些经典案例:
- 流感病毒不会全身性传播,因此不会在血液样本中发现。猪肺炎支原体的口腔液体检测很少呈阳性结果,因为病原体通常附着在呼吸系统下部的纤毛上仅提交1个由PRRS导致流产的胚胎(阳性率仅为50%),应提交至少4个胚胎,以******限度地提高发现阳性样本的几率
- 在疾病病程后期采集样本,病原体不再存在。
- 流感病毒仅在鼻分泌物中存在3-4天
- 引物不匹配PRR新毒株
- 猪群患病率低,抽样动物未感染
- 需要显著增加采样的动物数量
- 由于合并而稀释弱阳性样本合并传统上已稀释的口腔液样本(测试多头猪,阳性样本中预期的高Ct值)
阳性样本
- 病原体真正呈阳性的样本/猪群
- 无法区分样本是否具有传染性
- 根据靶向病原体的不同,检测DNA/RNA并不总是能确诊疾病
- 猪肺炎支原体PCR阳性肺组织证实组织中存在该病原体,但不能证实该病原体的严重性或临床意义。在大多数猪群中(不包括支原体阴性猪群),需要目视确认肺损伤的百分比(总体评估),以确定结果的临床意义。对猪圆环病毒2型(PCV2)PCR检测呈阳性的血清证实了PCV2的存在,但不能确定消瘦或肺炎是否归因于PCV2,也不能确定是否发生了疫苗接种失败。需要对肺和/或淋巴组织进行免疫组织病理学检查,以证明与PCV2相关的疾病。该检测可能无法区分疫苗病毒/细菌、改良活疫苗和野生型感染。了解使用疫苗的接种时间和类型至关重要可能需要测序信息
- 如果样品处理不当会造成交叉污染
- 尤其是在合并样本时。合并应在实验室内进行。从地板上采集的粪便样本可能会被病原体的环境残留物交叉污染
- 低Ct值与样本中的高病毒/细菌浓度相关,通常与更高的临床疾病相关
- 粪便中胞内劳森菌的低Ct值更可能与肠道病变有关。
- Ct < 20 → 猪增生性肠炎
- Ct > 30 →未检测到肠道病变
基因分型
- PCR基因分型的使用越来越普遍,尤其是对大肠杆菌。它提供了有关影响猪群分离株变化的流行病学信息(例如H1N1流感与H3N2流感)。
- 基因分型结果通常用于帮助选择疫苗的使用,例如大肠杆菌(确认菌毛)。
- 重要的是要记住,结果只代表一个分离株,而且猪经常同时感染多个分离株
- 检测仅确认毒力基因的存在,但不确认其表达。通常只要知道它具有表达基因的遗传潜力就足够了。
- 随着基因测序的成本和易用性继续降低,PCR基因分型的使用或需要将减少。
相关热词搜索:
上一篇:进行诊断的实用技巧
下一篇:猪得了脑炎会传染吗?猪得了脑炎用什么药治疗效果好?








 推荐新闻
推荐新闻












